DNA是生命的藍圖,當藍圖出錯時,如果能夠精準找到出錯的部份,把有問題的片段「剔除」或「校對」,或許就有機會能夠治癒疾病。但人體 DNA 鹼基序列有 65 億個,要找到目標 DNA(target DNA)片段,並精準切割,有如大海撈針,談何容易?
CRISPR / Cas9 切割 DNA,從細菌獲得的靈感
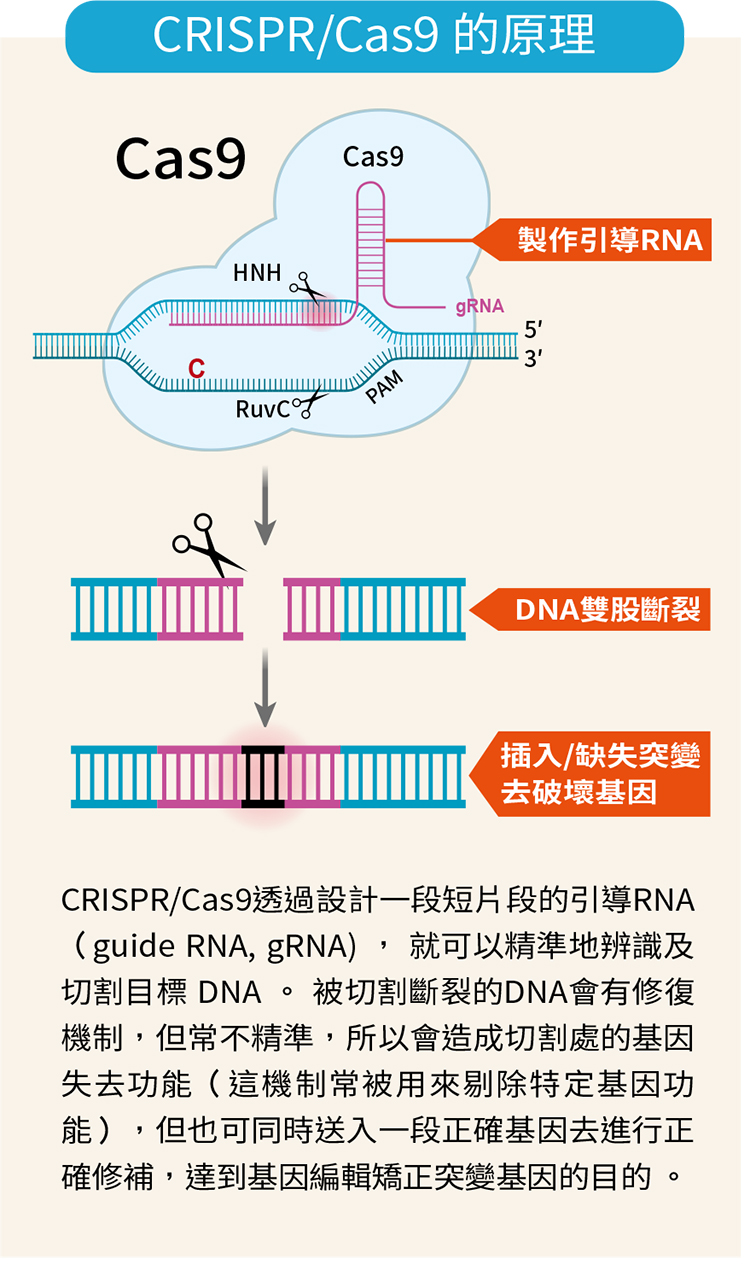
2020年諾貝爾化學獎頒給美國生物化學家道納(Jennifer Doudna)和法國微生物學家夏彭提耶(Emmanuelle Charpentier),就是因為她們於 2012 年發表的基因編輯技術 CRISPR / Cas9 易於操作,透過設計一段短片段的引導 RNA(guide RNA, gRNA) ,就可以精準地辨識及切割目標 DNA,讓透過基因編輯去治療疾病的可行性大為提高。
CRISPR / Cas9透過設計一段短片段的引導 RNA(guide RNA, gRNA), 就可以精準地辨識及切割目標 DNA 。 被切割斷裂的 DNA 會有修復機制,但常不精準,所以會造成切割處的基因失去功能(這機制常被用來剔除特定基因功能),但也可同時送入一段正確基因去進行正確修補,達到基因編輯矯正突變基因的目的 。
CRISPR全名是 clustered, regularly interspaced, short palindromic repeats,字面上的意思是「叢集有規律間隔的短迴文重複序列」。1987年日本科學家在大腸桿菌的基因組發現有特別的規律序列,某一小段 DNA 會一直重複,重複片段之間又有相等長的間隔,此序列就稱為 CRISPR,而 Cas9 全名為 CRISPR associated protein 9,則是細菌裡一種會去切割DNA的酵素,它會辨認出外來的 DNA,切下其中一個基因片段收藏起來,等這外來的 DNA 下次再出現,細菌就可以迅速辨識出予以消滅,可說是細菌後天發展出的適應性免疫系統。
要治癒 B 型肝炎,消滅 cccDNA 是關鍵
目前慢性 B 型肝炎只能藉由干擾素或口服抗病毒藥物來抑制病毒複製,達到血液中測不到 B 肝病毒的效果,但無法治癒,主要是因為肝細胞裡面還躲藏著具有複製能力的 B 肝病毒共價閉合環狀 DNA(covalently closed circular DNA, cccDNA)。一個受 B 肝病毒感染的肝細胞裡,約可躲藏著 30 到 50 個具有複製能力的 cccDNA,可說是 B 肝病毒複製的模板,一旦停藥或免疫力下降,cccDNA 就可能再度活化,複製大量 B 肝病毒,興風作浪。
科學家想到,是否能活用基因編輯技術 CRISPR/Cas9,精準切割 B 肝病毒之 cccDNA,讓已經存在受感染肝細胞內的 cccDNA 大幅減少或甚至是完全消失,達到根治 B 型肝炎的目標?
2014 年楊宏志教授等人發表在《Molecular Therapy Nucleic Acids》期刊的研究(註1),就是利用CRISPR/Cas9 來精準切割 cccDNA,並且也證實在 B 型肝炎小鼠動物模式中可行。但是人體感染 B 肝病毒後,肝細胞內不只有攆不走的 cccDNA,在肝細胞的基因體內,還嵌入了 B 肝病毒去氧核醣核酸(integrated HBV DNA),integrated HBV DNA 雖然沒辦法形成完整的 B 肝病毒序列,因此不像 cccDNA會一直複製出 B 肝病毒顆粒,卻有可能會不斷製造出 B 肝表面抗原(HBsAg),干擾 B 肝表面抗原的清除。
CRISPR/Cas9 在切割 cccDNA 的目標 DNA 時,也會切割 integrated HBV DNA,聽起來似乎是一石二鳥的妙計,但卻會導致宿主 DNA 雙股斷裂的後果,在修補的過程中,有可能會增加癌化的風險,等於解決一個問題時,可能又同時創造另一個新的問題,有安全上的疑慮。
採用新一代基因編輯工具,化解致癌危機
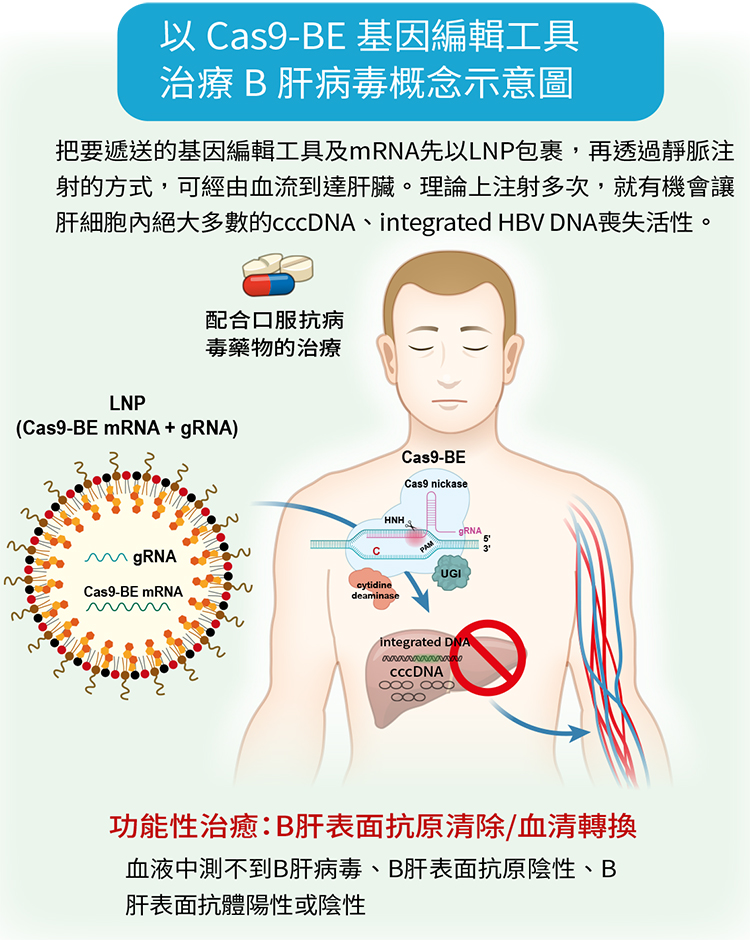
於是楊宏志教授等人在 2020 年發表的研究(註2)中,改為使用新一代的 Cas9 鹼基編輯工具,簡稱 Cas9-BE,這個工具把原本負責切割 DNA 的 Cas9 酵素去活化,接了一個新的 APOBEC 1 酵素(apolipoprotein B mRNA editing enzyme, catalytic polypeptide 1),這個新的酵素可以進行基因鹼基編輯。
在生物學上,DNA有A、T、C、G 四種鹼基。APOBEC 1 酵素可以把 DNA 的四個鹼基中的 C 編輯成 T,而在與之互補的對股上會把 G 編輯成 A。如此就能讓 cccDNA、integrated HBV DNA 壞掉而失去活性,即使不切割 DNA,也能達到讓 B 肝病毒無法複製、表面抗原(HBsAg)也被破壞的目標,因此,也就不會造成宿主基因的雙股斷裂,讓基因編輯用於治療 B 型肝炎上的安全性大為提高。
利用 LNP 包裹,有效遞送到肝臟
而運用在臨床上,最大的挑戰是能不能有很好的運輸系統,把要遞送的基因編輯工具以 messenger RNA(mRNA)的形式加上引導 RNA 順利精準的運送到肝細胞,才能發揮功能。科學家常使用一種腺相關病毒,利用病毒會感染人體的特性,把基因編輯工具送進細胞內,但使用病毒要考慮會不會引發人體的免疫反應,以及病毒 DNA 會不會嵌入人體基因等,所以在 B 肝研究中是使用脂質奈米顆粒(lipid nanoparticle, LNP)。而採用 LNP 包裹 Cas9 mRNA 去進行人體基因治療疾病,已在一種「類澱粉沉積心肌病變」(簡稱 AATR)上獲得驗證(註3)。
肝臟本來就是脂質代謝的標的,因此,把要遞送的基因編輯工具及 mRNA 先以 LNP 包裹,再透過靜脈注射的方式,可經由血流到達肝臟。理論上注射多次,就有機會讓肝細胞內絕大多數的 cccDNA、integrated HBV DNA 喪失活性。楊宏志教授等人的研究已證實在細胞試驗上可行,接下來打算進行動物試驗,以感染B肝病毒的小鼠進行研究,盼能達到根除B型肝炎的希望。
需避免基因遭到意外修改,強化安全性
利用基因編輯治療B肝,優點是可直接針對病毒cccDNA及integrated HBV DNA,使其不活化,等於是釜底抽薪的辦法,可達到徹底根除的可能性,但是還有一些需要克服之處。
除了有效性外,降低脫靶效應(off-target effects)一直是基因編輯治療中必須重視的一大關鍵課題。脫靶效應指的是在進行基因治療時,意外修改了不應改變的基因片段,因有可能會造成人體不可預期的傷害,所以不希望發生,尤其B型肝炎目前已經有不錯的干擾素及口服抗病毒藥物可以有效控制病情,因此基因編輯治療的安全性需要多方確認,否則也不急於用在B型肝炎的根除治療上。同時,由於B肝病毒有很多基因型,是否能挑到一種好的gRNA,能夠適用於各種基因型的B肝病毒,會是另一個挑戰。
此外,研究人員發現,人體感染B肝病毒後,嵌入的integrated HBV DNA也常是插在致癌基因(oncogene)旁,且常會造成端粒酶的高度表達。端粒酶的作用是可讓細胞延遲老化,所以腫瘤細胞一定有端粒酶,肝癌細胞也不例外。雖然透過基因編輯方式可讓integrated HBV DNA不活化、B肝表面抗原不再製造,但integrated HBV DNA仍在,它本身就是致癌基因,也可以活化旁邊的基因,因此,藉由基因編輯,有沒有可能治癒B型肝炎的同時也降低肝癌風險?也是接下來要繼續努力的目標。
根除B肝病毒之研究發展蓬勃,成果指日可待
除了基因編輯外,其他試圖根治 B 肝的研究,大致可分為針對病毒及針對宿主免疫力兩大類。在針對病毒方面,有些研究是想辦法去抑制 B 肝病毒的蛋白質合成,進一步達到抑制病毒複製的效果,但這些研究與現有的抗病毒藥物一樣,因為無法清除已經存在的 cccDNA,所以仍無法達到根治的效果。
還有一個方向是針對 B 肝表面抗原,讓它不要分泌。B肝病毒有一個特性是製造出來的表面抗原比病毒顆粒還要多,由於病毒應該不會去做無意義的事,所以科學家推測這麼多表面抗原恐怕有些是「啞彈」,是為了搗亂、癱瘓人體的免疫力。如果可以把表面抗原減少,讓病毒蛋白質下降,可以讓人體免疫系統恢復能力去殺病毒。
例如一個試驗中的藥物核酸聚合物(nucleic acid polymer, NAP)就是抑制 B 肝表面抗原的釋放,在第一、二期臨床試驗看起來,搭配干擾素、口服抗病毒藥物一段時間以後,患者的表面抗原的數量確實降低或消失了,但仍需要再做第三期臨床試驗。
還有一種 siRNA(small interfering RNA)療法,即製造 20 個核苷酸序列的小片段 RNA,和 B 肝病毒製造蛋白的 RNA 結合,藉此干擾並且破壞 B 肝病毒的基因表現,達到抑制 B 肝表面抗原的作用。目前有研究顯示打一針可讓表面抗原無法產生,效果可維持 3~4 個月,但停藥後表面抗原還是會跑出來,所以還需要再打。
另外,2023年11月《肝臟學期刊》(Journal of Hepatology)也刊登一篇研究,是一款 RNA干擾(RNA interference, RNAi) 療法(編號RG6346)首次的人體隨機雙盲研究,數據顯示,能達到讓慢性 B 型肝炎患者的 B 肝表面抗原顯著且持久降低的效果,值得持續開發。
RNAi 的藥物機轉與「CRISPR/Cas9基因編輯技術」作法雷同,都屬於基因治療,差異則在於 RNAi 作用於RNA,作用是暫時性的,CRISPR 則是作用在 DNA,會造成基因的永久改變。
另一個很被看好的則是 ASO(antisense oligonucleotide)療法,概念上是跟病毒的 mRNA 去互補,互補之後會去破壞 mRNA,讓 B 肝表面抗原無法製造。根據已發表的研究,用 ASO 治療一段時間,表面抗原確實下降,有些人甚至消失,有效率約一成多。收案對象是使用口服抗病毒藥物超過半年測不到病毒的病人,臺大醫院也有病人參加收案,期待進入第三期臨床試驗。
針對宿主免疫力方面,也有研究在發展抗 B 肝病毒的疫苗,屬於治療性疫苗,希望產生清除 B 肝病毒的免疫力,不過尚未傳出好消息。
不管哪一種方式,都還是要搭配口服抗B肝病毒藥物。整體來說,全球有許多根治B肝的臨床試驗正在進行中,也許再過不久,就能看到具體成果!
※ 本文轉載自肝病防治基金會好心刊月刊第 105 期(諮詢專家:臺大醫院內科部主治醫師楊宏志)
文/肝病防治基金會 編輯/賴以玲 圖/楊紹楚