治療糖尿病的主要方式是監控血糖,嚴重者則會配合注射胰島素,都是屬於控制性的治療方式,並且沒有辦法完全避免併發症的產生;而移植胰島是另外一種治療的選擇,但沒有普遍化的原因在於,捐贈胰島者少,器官捐贈會產生的免疫排斥問題和胰島分離的費用昂貴,都限制了臨床上移植胰島的應用,這也成為生技醫學界的一項研究熱點。
2017年8月全球首宗以幹細胞治療糖尿病
2017年《NewScientist》的論文,指出加州聖地亞哥的研究團隊開發出PEC-Direct,它是一張含有胚胎幹細胞的植入物,大概就只有一張信用卡那麼大,上面的幹細胞可以在體內發育成被被I型糖尿病所破壞的胰島細胞。患者被研究團隊在皮膚下置入PEC-Direct,當血糖濃度過高的時候,就會釋放胰島素使血糖下降成正常濃度。而且植入物的表面上有孔洞,血液可以進入孔洞中培養胰島母細胞,約3個月後就會變為成熟的胰島細胞,來釋放胰島素,維持體內血糖的恆定性。
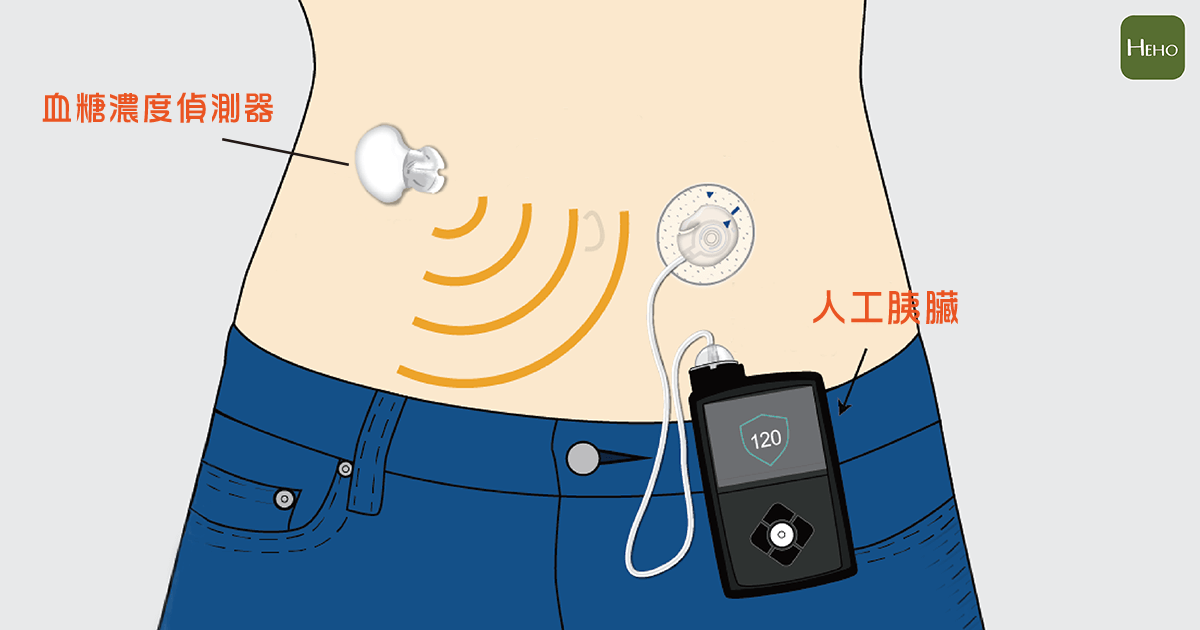
人工胰臟裝置
在2017年,FDA也核准了混合閉環胰島素輸送系統(Hybrid Closed-Loop Insulin Delivery System),它可以改善糖尿病患者的血糖管理,被稱之為為世界首個「人工胰臟」,並利用SmartGuard HCL算法來推斷出何時以及輸送多少胰島素,病人可以輸入每頓飯後碳水化合物的攝取量,來控制胰島素的給藥量,還可以定期校準對傳統的傳統採血血糖機的感測器,也允許患者自行修改數據。
它的Guardian傳感器在沐浴或睡覺時都可以配戴,並且執行每5分鐘測量葡萄糖濃度的功能長達一周,而且又擁有自動校準性,可自動幫助保持傳感器保持測量間的準確性,確保胰島素的輸送量是正確的。
幹細胞釋放生長因子治療糖尿病的併發症
此外,糖尿病患者可能因為體內的代謝紊亂而引起心腦血管疾病、視網膜病變、腎臟病和創傷癒合不良等大量的併發症,降低了患者的生活品質,比起糖尿病這些併發症更可能導致患者死亡。而透過幹細胞釋放可溶性生長因子和細胞因子,來刺激新血管的形成和調節發炎反應,也為糖尿病併發症提供了新的治療方式。
延伸閱讀
文/黃聖筑 圖/許嘉真